مقاومت ضد میکروبی (AMR) به یکی از مهلک ترین تهدیدهای بهداشت جهانی در قرن ۲۱ تبدیل شده است. اگرچه سالها تمرکز اصلی پژوهشها بر انتقال این مقاومت بین بیماران یا از طریق محیط بوده است، اما مطالعات جدید نشان میدهد که بخشی از مشکل درون بدن خود بیماران شکل میگیرد. این پست وبلاگ با بررسی مکانیسمهای بومشناختی و تکاملی انسان ها و حیوانات، نشان میدهد که چگونه باکتریها در طول درمان میتوانند بهطور مستقیم در بدن بیمار دچار مقاومت شوند. این موضوع، درمانهای رایج را به چالش می کشد. در این مطلب، به توضیح چیستی مقاومت ضدمیکروبی، مسیرهای شکلگیری آن و راهکارهایی برای مقابله با این معضل جهانی میپردازیم.
مقاومت ضدمیکروبی چیست؟
مقاومت ضد میکروبی (antimicrobial resistance) زمانی رخ میدهد که میکروبها در برابر داروهایی که برای نابودی یا مهار رشدشان ساخته شدهاند، توان دفاعی پیدا میکنند. وقتی میکروب در برابر داروهای ضد باکتریایی(آنتی بیوتیک) یا حتی داروهای ضدویروس و ضدانگل مقاوم شود، می گوییم مقاومت دارویی رخ داده. وقتی صرفا راجع به مقاومت باکتری به آنتی بیوتیک حرف می زنیم، به آن مقاومت آنتی بیوتیکی می گوییم.
آنچه که در این مطلب متمایز است، این است که بسیاری از این مقاومتها نه از بیرون، بلکه در خود بدن بیمار و در طول درمان پدید میآید.
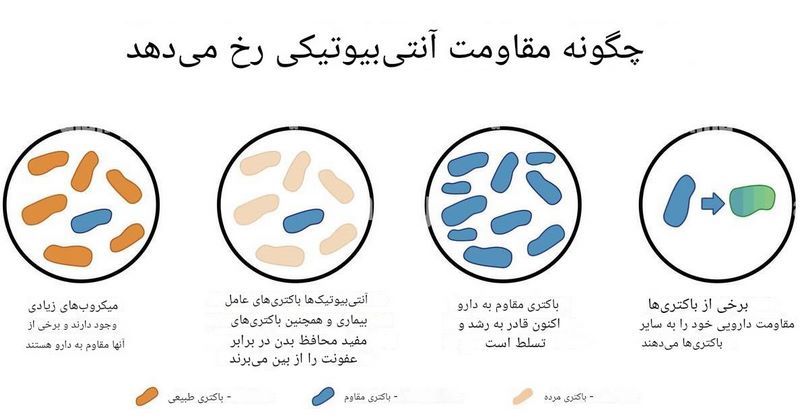
4 مکانیسم اصلی مقاومت درون بدن بیمار
1. جهشهای خودبهخودی:
در باکتریهایی مانند مایکوباکتریوم توبرکلوزیس (Mycobacterium tuberculosis) و سودوموناس آئروژینوزا (Pseudomonas aeruginosa) تغییرات تصادفی در ژنوم ایجاد میشود که آنها را در برابر دارو مقاوم میکند.
2. انتقال افقی ژنها :
در این مسیر، باکتریها از یکدیگر ژنهای مقاومت را قرض میگیرند. این حالت بیشتر در روده مشاهده میشود، جایی که تنوع و تراکم میکروبی بالاست و گونههایی مانند اشرشیا کلی (Escherichia coli) و کلبسیلا پنومونیه (Klebsiella pneumoniae) فرصت زیادی برای تبادل ژنی دارند.
این تبادل از چند راه رخ میدهد:
- پلاسمیدها: قطعات کوچک دی ان ای (DNA) که بهراحتی بین باکتریها جابهجا میشوند و اغلب ژنهای مقاومت را حمل میکنند.
- ترانسپوزونها : قطعات متحرک دی ان ای (DNA) که میتوانند جای خود را در ژنوم عوض کنند و ژنهای مقاومت را همراه خود منتقل نمایند.
- فاژها (باکتریخوارها): ویروسهایی که به باکتریها حمله میکنند و گاهی ژنهای مقاومت را از یک باکتری به دیگری میبرند.
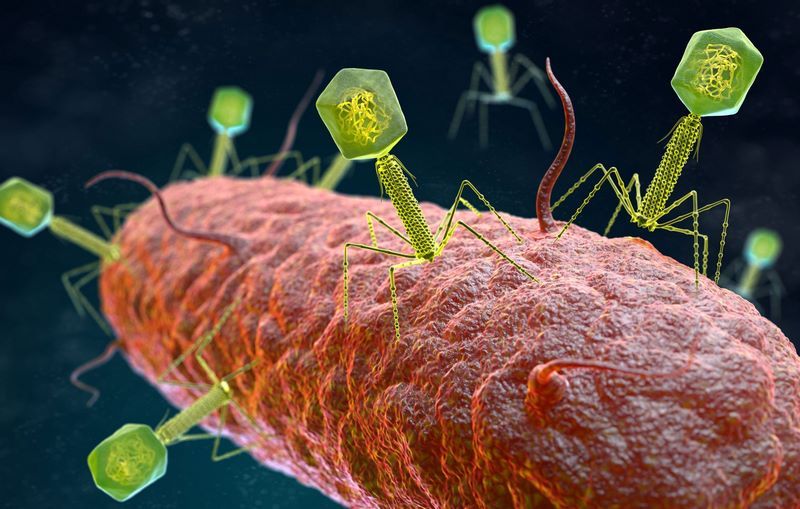
3. غالب شدن سویههای مقاوم از پیش موجود:
در این حالت، بخشی از جمعیت باکتری ها از ابتدا مقاوم هستند و هنگام درمان با دارو بهسرعت غالب میشود. در عفونت ریه ناشی از سودوموناس آئروژینوزا در بیماران فیبروز سیستیک (CF) با سیستم ایمنی ضعیف این مورد دیده می شود. هلیکوباکتر پیلوری (Helicobacter pylori) نیز باعث ایجاد عفونت های مقاوم در معده می شود. بیماریهای گوارشی مانند زخم معده، عفونت معده، ورم معده و در موارد حاد حتی سرطان معده ممکن است توسط بیماران مبتلا به این پاتوژن رخ دهند.
4. مهاجرت سویههای مقاوم :
کلونهای مقاوم میتوانند از بخشهای دیگر بدن، مانند روده یا پوست به محل عفونت (مثلاً مجاری ادراری یا ریه) منتقل شوند و درمان را بیاثر کنند.
این مکانیسمها بسته به نوع باکتری، جایگاه عفونت و شرایط بدن بیمار متفاوت عمل میکنند. برای نمونه، در ریه بیماران فیبروز کیستیک، جهشهای مکرر مشاهده میشود، در حالی که در روده، انتقال افقی ژنها بیشتر نقش دارد.
نکته: این چهار مسیر با هم تعامل دارند و جدا از هم نیستند. گاهی مهاجرت با جهش ترکیب میشود. مثلاً در عفونتهای مزمن استافیلوکوکوس اورئوس مقاوم به متیسیلین (MRSA)، ابتدا سویهای مقاوم از روده به زخم مهاجرت کرده و سپس با جهشهای جدید، مقاومت بیشتری ایجاد کرده است.
خطرات مقاومت دارویی چیست؟
طبق آمار، تنها در سال ۲۰۱۹ حدود ۴.۹۵ میلیون مرگ با مقاومت آنتیبیوتیکی مرتبط بوده است. از سوی دیگر، سرعت گسترش مقاومت ضد میکروبی، سرعت کشف و تولید داروهای جدید را پشت سر گذاشته است. در حالی که ساخت یک آنتیبیوتیک جدید سالها زمان میبرد، یک باکتری میتواند طی چند هفته یا چند ماه در بدن بیمار مقاوم شود. این عدم توازن، آینده پزشکی مدرن را به شدت تحت تاثیر قرار می دهد.
عوامل مؤثر بر ظهور مقاومت
پژوهشگران نشان میدهند که چرا و چگونه مسیرهای ایجاد مقاومت ضد میکروبی در بیماران متفاوت است. این تفاوتها به چند عامل اصلی برمیگردد:
گونههای باکتریایی
هر باکتری مسیر ویژهای برای مقاوم شدن دارد. به 2 مثال زیر توجه کنید:
- اشرشیا کلی (Escherichia coli) تنوع ژنی زیادی دارد و بنابراین بیشتر از طریق انتقال افقی ژنها (مثل پلاسمیدها) مقاومت کسب میکند.
- مایکوباکتریوم توبرکلوزیس (Mycobacterium tuberculosis) که عامل سل است، تعامل کمی با باکتریهای دیگر دارد و تقریباً همیشه از راه جهشهای خودبهخودی مقاوم میشود.
محل عفونت در بدن
- در روده که تنوع بالایی از میکروب ها وجود دارد، مقاومت بیشتر با انتقال افقی ژنها رخ میدهد.
- در خون یا مایع مغزی-نخاعی که محیطی استریل یا با جمعیت اندک میکروبهاست، بیشتر مقاومتها از طریق جهش ایجاد میشوند.
- در مجاری ادراری به دلیل نزدیکی به روده، مهاجرت سویههای مقاوم شایع است.
مدت زمان عفونت
در عفونتهای مزمن، جمعیت باکتری فرصت بیشتری برای تنوع ژنتیکی و انباشتهشدن جهشهای مقاوم پیدا میکند.
شیوه زیستی باکتری
بسیاری از باکتریها مثل سودوموناس آئروژینوزا (Pseudomonas aeruginosa) در قالب بیوفیلم رشد میکنند. بیوفیلمها لایهای محافظ ایجاد کرده و هم مانع نفوذ آنتیبیوتیک میشوند و هم شرایطی فراهم میکنند که جهش و تبادل ژن بیشتر رخ دهد.
ایمنی بدن میزبان
یک سیستم ایمنی سالم میتواند حتی سویههای مقاوم را پاکسازی کند. ولی در بیماران با ایمنی ضعیف مثل بیماران آی سی یو (ICU) یا دریافتکنندگان پیوند، فرصت برای مهاجرت و تثبیت مقاومت بسیار بیشتر است.
از بین بردن مقاومت دارویی
شناخت مسیرهای ایجاد مقاومت ضد میکروبی میتواند پزشکان را در انتخاب درمان بهتر یاری دهد. برای مثال، اگر عامل اصلی مقاومت در بیماری خاصی جهشهای سریع باشد، تجویز همزمان چند دارو میتواند احتمال بروز جهش در میکروب ها را کاهش دهد. در مقابل، اگر مهاجرت سویههای مقاوم از روده عامل اصلی باشد، راهبردهای کنترل میکروبیوم یا پروبیوتیکها میتوانند در مؤثر باشند. در دهه اخیر، استفاده از پروبیوتیک در انسان ها و صنعت پرورش مرغ به شدت بالا رفته است. فرهنگ استفاده از پروبیوتیک برای طیور و سایر دام ها و حیوانات خانگی به سرعت در حال جا افتادن است.
حال در بخش زیر، بررسی می کنیم که چگونه میتوان مقاومت دارویی را مهار کرد:
1. مدیریت مصرف آنتیبیوتیکها:
تجویز بیرویه دارو باید متوقف شود. هر دوز غیرضروری میتواند فرصت انتخاب برای سویههای مقاوم ایجاد کند.
2. پایش ژنومی :
توالییابی ژنوم باکتریهای عامل عفونت در بیماران، به پزشکان امکان میدهد مسیرهای ایجاد مقاومت را شناسایی کنند. برای نمونه، اگر مشخص شود که مقاومت بیشتر از طریق انتقال افقی ژنها رخ میدهد، پزشک میتواند درمانی انتخاب کند که کمتر تحتتأثیر این مکانیسم قرار گیرد.
3. استفاده از ترکیبهای دارویی:
درمان ترکیبی با استفاده از چند دارو، میتواند شانس بقا و تکثیر سویههای مقاوم را کاهش دهد.
4. جایگزین کردن داروی های گیاهی با شیمیایی:
برخی ترکیبات طبیعی موجود در گیاهان دارای خاصیت ضدباکتریایی هستند. استفاده هوشمندانه از این ترکیبات میتواند در کاهش مصرف آنتیبیوتیکهای شیمیایی کمک کند. این موضوع دو مزیت دارد:
الف. فشار انتخابی کمتری بر باکتریها وارد میشود و احتمال شکلگیری مقاومت کاهش مییابد.
ب. ترکیبات گیاهی اغلب چندهدفه عمل میکنند و ممکن است مکانیسم مقاومت مشخصی برای آنها در باکتریها وجود نداشته باشد.
5. کنترل میکروبیوم :
با حفظ تعادل میکروبهای مفید روده یا پوست میتوان جلوی انتقال افقی ژنها را گرفت.

6. کنترل مصرف آنتی بیوتیک در دام و طیور:
بخش بزرگی از آنتیبیوتیکهای تولیدی جهان در صنعت دامپروری و مرغداری مصرف میشوند. استفاده بیرویه از این داروها برای رشد سریعتر دام یا پیشگیری غیرضروری از بیماریها، به پیدایش و گسترش باکتریهای مقاوم در حیوانات منجر میشود. این باکتریها یا ژنهای مقاومت آنها میتوانند از طریق زنجیره غذایی، محیط زیست یا تماس مستقیم به انسان منتقل شوند.
با محدود کردن مصرف آنتیبیوتیک در دامها و جایگزینی روشهای بهداشتی و واکسیناسیون، میتوان فشار انتخابی بر باکتریها را کاهش داد و از شکلگیری مقاومت جلوگیری کرد. این اقدام علاوه بر سلامت دام، نقش مهمی در حفاظت از سلامت عمومی انسان دارد.
برای پیشگیری و درمان بیماری های ناشی از باکتری های بیماری زا می توان از آنتی بیوتیک گیاهی آریوبیوتیک (ArioBiotic) استفاده کرد. این دارو با مکانیسمهای متعدد اثر بر باکتریها، از ایجاد مقاومت دارویی جلوگیری کرده و فاقد دوره پرهیز از مصرف یا باقیماندههای سمی در محصولات دامی است. هدف تولید این دارو جایگزین کردن ترکیبات گیاهی به جای شیمیایی و بهبود امنیت غذایی مردم کشورمان ایران است.
برای اطلاعات بیشتر راجع به آنتی بیوتیک گیاهی آریوبیوتیک کلیک کنید
برای اطلاعات بیشتر درباره آنتی بیوتیک نانوکپسوله طیور کلیک کنید
سخن پایانی: آینده مبارزه با مقاومت ضد میکروبی
هر چهار مکانیسم مقاومت ضد میکروبی در بیماران مشاهده میشود، اما شدت و اهمیت آنها بسته به موقعیت متفاوت است. بنابراین، راهحل واحدی برای جلوگیری از ایجاد مقاومت در تمام پاتوژن ها وجود ندارد و تنها با ترکیب دادههای ژنومی، بالینی و بومشناختی میتوان برنامهای جامع برای مهار مقاومت دارویی تدوین کرد. آینده مبارزه با مقاومت ضد میکروبی، در گذار از درمانهای کلی به پزشکی شخصی – تخصصی شده نهفته است؛ رویکردی که با استفاده از توالییابی ژنومی و هوش مصنوعی، پرونده مقاومت باکتری را در هر بیمار به طور دقیق شناسایی کرده و درمانی هدفمند مانند مختل کردن بیوفیلم یا استفاده از ترکیبات ضد حسگری را تجویز میکند.