تاثیر متابولیسم باکتری ها در مقاومت ضد میکروبی (AMR)
در این وبلاگ به بررسی رابطه پیچیده بین متابولیسم باکتریایی و مقاومت ضد میکروبی در برابر آنتی بیوتیک ها می پردازیم. درک این رابطه بسیار مهم است؛ از یک سو، آنتی بیوتیک ها برای عملکرد خود به متابولیسم سلولی وابسته اند; و از سوی دیگر، تحقیقات نشان داده اند که وضعیت متابولیکی سلول بر تمام جنبههای زیستشناسی آنتیبیوتیک، از اثربخشی دارو تا تکامل مقاومت ضد میکروبی (AMR)، تأثیرگذار است. با توجه به اینکه مقاومت ضد میکروبی تهدیدی رو به رشد برای داروهای فعلی آنتیبیوتیک و توانایی درمان بیماری های عفونی است، درک این روابط برای ارتقا سلامت عمومی حیاتی است. با این حال، سنجش میزان مشارکت متابولیسم در فعالیت آنتی بیوتیکی و تکامل باکتریایی حاصل از آن، کاری دشوار است.
ابتدا خلاصه ای از چگونگی بهره برداری آنتی بیوتیک ها از متابولیسم برای عملکرد بهینه شان ارائه می کنیم. سپس به سمت عکس این رابطه می رویم و به طور مشخص، نقش منحصر به فرد متابولیسم را در سه بخش متمایز ولی مرتبط با زیستشناسی آنتیبیوتیکی بررسی میکنیم:
- اثربخشی آنتیبیوتیک
- تکامل مقاومت ضد میکروبی نسبت به آنتی بیوتیک ها (مقاومت آنتی بیوتیکی)
- اهمیت متابولیسم در زمینههای بالینی
در ادامه، آینده ی روش های مبتنی بر متابولیسم برای درمان های آنتی بیوتیکی را بررسی می کنیم. توسعه درمان های مؤثر در مقابله با چالش مقاومت ضدمیکروبی (AMR) تنها با درک عمیق تاثیر متابولیسم باکتری ها در مقاومت، امکان پذیر است.
کشف آنتی بیوتیک ها
کشف آنتیبیوتیکها یکی از مهمترین پیشرفتهای پزشکی قرن بیستم بود که با کشف پنیسیلین توسط الکساندر فلمینگ در سال ۱۹۲۸ آغاز شد. فلمینگ بهطور اتفاقی متوجه شد که کپک پنیسیلیوم روی یک ظرف کشت باکتری، مادهای تولید میکند که باکتریهای اطراف را از بین میبرد. این کشف، زمینهساز توسعه آنتیبیوتیکها شد و در دهههای بعد، دانشمندانی مانند ارنست چین و هوارد فلوری روشهای تولید انبوه پنیسیلین را بهبود بخشیدند، که بهویژه در جنگ جهانی دوم جان میلیونها نفر را نجات داد. پس از پنیسیلین، آنتیبیوتیکهای متعددی مانند استرپتومایسین و تتراسایکلین کشف شدند که به درمان بیماریهای عفونی کمک کردند و انقلابی در پزشکی مدرن ایجاد کردند.
کشف آنتی بیوتیک ها بی تردید یکی از دستاوردهای تحول آفرین در پزشکی مدرن به شمار می آید که طول عمر انسان را بیش از ۲۰ سال افزایش داده است. آنتی بیوتیک ها در حفظ استریلیته و کنترل عفونت در فرآیندهای پزشکی پیچیده مانند شیمیدرمانی، پیوند عضو و مراقبتهای روتین نظیر کشیدن دندان و زایمان، نقشی حیاتی دارند.
مقاومت ضد میکروبی چیست؟
استفاده گسترده از آنتیبیوتیکها برای مقابله با انواع مختلف عفونتهای باکتریایی، باعث ظهور پدیده مقاومت ضد میکروبی (AMR یا Antimicrobial Resistance) شده است؛ حالتی که در آن باکتریها قادرند با وجود حضور آنتیبیوتیکها زنده بمانند و تکثیر شوند و در نتیجه، درمان بیاثر میگردد. سوء استفاده و استفاده بیش از حد از آنتی بیوتیک ها در محیط های بالینی (پزشکی و دامپزشکی) و کشاورزی، به طور قابل توجهی به افزایش شیوع مقاومت ها دامن زدهاند.
امروزه، این مشکل به عنوان یک بحران جهانی رو به رشد مورد توجه پزشکان، دانشمندان و سیاست گذاران قرار گرفته است. با افزایش پیوسته تعداد ارگانیسم های مقاوم به چند دارو و کاهش آنتی بیوتیک های مؤثر، پیش بینی ها نشان می دهند که بین سال های ۲۰۲۵ تا ۲۰۵۰، بیش از ۱۶۹ میلیون مرگ در سراسر جهان با مقاومت ضد میکروبی (AMR) در ارتباط خواهد بود.
مقاومت ضد میکروبی در باکتری ها عمدتاً ناشی از سازوکارهای ژنتیکی است؛ این معضل می تواند از طریق تغییرات ژنتیکی طبیعی و گسترش کلونی حاصل شود یا از طریق انتقال افقی عناصر ژنتیکی متحرک بین سلول ها (Horizontal Gene Transfer – HGT) به وجود آید.
1. تغییر در فرایند انتقال دارو:
منجر به کاهش غلظت درون سلولی آنتی بیوتیک می شود؛ این فرآیند ممکن است از طریق کاهش نفوذپذیری غشای سلولی یا افزایش فعالیت پمپهای افلاکس (efflux pumps) رخ دهد، که به ترتیب ورود آنتیبیوتیک به سلول را محدود کرده یا خروج فعال آن را از سلول تسریع میکنند، در نتیجه اثربخشی دارو کاهش مییابد.
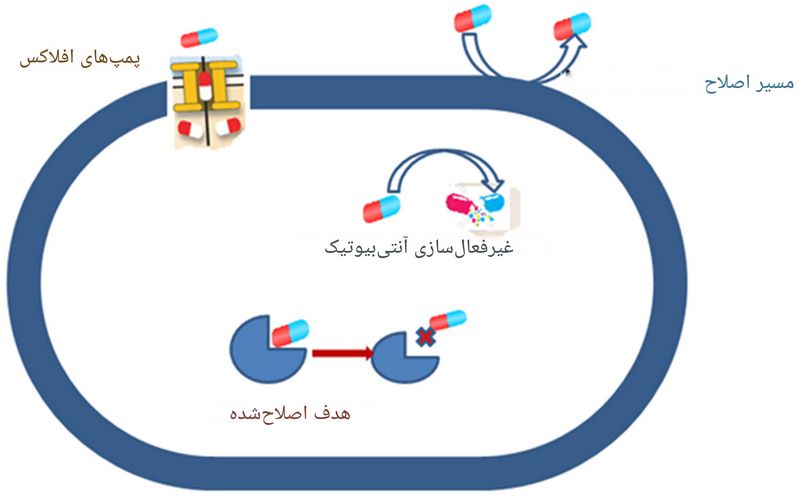
2. غیرفعالسازی مستقیم آنتیبیوتیک (اغلب از طریق هیدرولیز آنزیمی):
باکتریها میتوانند آنتیبیوتیک را مستقیماً غیرفعال کنند، یعنی کاری کنند که دارو دیگر اثر نکند. این کار معمولاً با استفاده از آنزیمهای خاصی در باکتری انجام میشود که آنتیبیوتیک را تجزیه یا خراب میکنند. مثل این است که باکتری یک قیچی شیمیایی داشته باشد که دارو را تکهتکه کند تا بیاثر شود.
3. جلوگیری از اتصال آنتیبیوتیک به محل هدف:
مانند جهش در پروتئینهای متصلشونده به پنیسیلین که از اتصال دارو جلوگیری می کند. مکانیسم مقاومت دارویی در مورد سوم شامل تغییرات ساختاری یا عملکردی در اهداف مولکولی آنتیبیوتیک است که مانع از اتصال مؤثر دارو به محل هدف می شود.
این تغییرات اغلب از طریق جهش های ژنتیکی در ژن های کد کننده پروتئین های هدف، رخ می دهند که منجر به کاهش یا حذف جذب شیمیایی (میل ترکیبی اجزای شیمیایی غیر مشابه با یکدیگر) آنتیبیوتیک به این پروتئینها شده و در نتیجه اثربخشی درمانی دارو را مختل میکند.
در مجموع، این سازوکارهای مقاومت، دارو های آنتیبیوتیک فعلی را تهدید میکنند. به ویژه این تهدید از آنجا که توسعه داروهای جدید نتوانسته با سرعت تکامل باکتریایی همگام شود؛ جدی تر می شود.
تاثیر آنتی بیوتیک بر متابولیسم باکتری
آنتیبیوتیکها با تغییر در متابولیسم باکتری، نقش مهمی در مرگ یا توقف رشد آن دارند.
آنتیبیوتیکهای باکتریکش یا باکتریوسید (Bacteriocide)، پس از مهار اهداف حیاتی مانند سنتز دی ان ای (DNA)، پروتئین یا دیواره سلولی، باعث اختلال در مسیرهای متابولیکی اصلی مثل چرخه اسید تری کربوکسیلیک (TCA) و زنجیره انتقال الکترون میشوند. این اختلال ها باعث افزایش مصرف اکسیژن، تولید آدنوزین تریفسفات (ATP) و گونه های فعال اکسیژن میشوند که در نهایت به مرگ سلول منجر میگردد. بنابراین، مرگ باکتری تنها به اثر مستقیم دارو محدود نمیشود، بلکه تغییرات متابولیکی ثانویه نیز نقش مهمی در این فرآیند دارند.
در مقابل، آنتی بیوتیک های مهارگر باکتری یا باکتریواستات (Bacteriostat) با کاهش فعالیتهای متابولیکی و متوقف کردن ساخت اجزای مهم سلولی، رشد باکتری را متوقف میکنند. در این حالت، سلولها ممکن است متابولیت های انرژیزا را انباشته کرده و وارد حالتهای متابولیکی خاصی شوند. گاهی اوقات، این شرایط منجر به شکل گیری سلول های پایدار (Persister cells) می شود که دستهای از سلولهای باکتریایی هستند که در برابر انواع آنتی بیوتیک ها مقاومند و به طور موقت تقسیم نمی شوند.
این سلول ها معمولاً در بیوفیلم ها (biofilms) یافت میشوند و نقش مهم در ایجاد مقاومت آنتیبیوتیکی و عفونتهای مزمن دارند.
این سلولها معمولاً به دلیل فعال شدن پاسخهای استرسی مانند کاهش سطح انرژی سلولی پدید میآیند.
در مجموع، این یافته ها نشان می دهند که شناخت دقیق وضعیت متابولیکی باکتری ها در هنگام درمان، برای درک بهتر پاسخ دارویی و مقابله مؤثر با مقاومت آنتی بیوتیکی ضروری است.
آنتی بیوتیک ها و شرایط متابولیکی بدن
در محیط بدن میزبان، شرایط متابولیکی بافتها بر رفتار باکتریها و اثربخشی آنتیبیوتیکها تأثیر چشمگیری دارند. برای مثال، در عفونت های دستگاه ادراری گربه که ناشی از باکتری اشرشیا کلی (E. coli) می باشد، وجود ترکیباتی مانند اوره و نیتروژن در ادرار و تغییرات پی اچ (pH) محیط می توانند باعث تغییر مسیرهای متابولیکی باکتری شوند.
علاوه بر آن، تحلیل بیش از ۳٬۵۰۰ سویه بالینی اشرشیا کلی (E. coli) نشان داده است که این باکتری ها تنوع زیادی در جهش های ژن های متابولیکی دارند که به آن ها امکان می دهد خود را با شرایط متغیر میزبان تطبیق دهند. این تنوع متابولیکی، یکی از عوامل کلیدی در پایداری و بقا در برابر درمان آنتی بیوتیکی است و می تواند باعث مقاومت ضد میکروبی شود. بنابراین، شناخت وضعیت متابولیکی باکتری در محل عفونت برای انتخاب درمان مؤثر اهمیت زیادی دارد.
راه درمان مقاومت آنتی بیوتیکی
متابولیسم باکتری تقریباً در تمام جنبه های پاسخ به آنتی بیوتیک ها نقش دارد. بنابراین، باید در توسعه آنتی بیوتیک های جدید و طراحی راهبردهای درمانی نوین، جایگاه ویژه ای برای آن قائل شد.
نقش متابولیسم در تعیین اثربخشی، مقاومت دارویی و تکامل مقاومت هنوز به طور کامل فهمیده نشده است و نیاز به تحقیقات بیشتری دارد.
درک بهتر روابط بین متابولیسم باکتری ها و مکانیسم مقاومت میکروبی، خصوصاً در بستر شبکه های پیچیده و محیط های واقعی مانند بافت های بدن یا بیوفیلم ها، میتواند به کشف راهکارهای نوآورانه برای مقابله با مقاومت ضد میکروبی منجر شود.
یکی از بهترین راه های درمان عفونت های مقاوم به دارو های ضد میکروبی و مقابله با مشکل مقاومت در انسان و دام، کاهش استفاده بی رویه از آنتی بیوتیک ها و جایگزین کردن آن با ترکیبات گیاهی ضد باکتری است. آنتی بیوتیک های گیاهی نظیر آریوبیوتیک (Ariobiotic) موجب ایجاد اختلال در مسیر متابولیکی باکتری های بیماری زا می شوند. این آنتی بیوتیک گیاهی موجب اختلال در غشای سلولی باکتری و مهار پمپ افلاکس می شود و از ایجاد مقاومت ضدمیکروبی جلوگیری می کند.